Thuốc ung thư của Nga được cấp phép ở Việt Nam: Bao giờ đưa vào điều trị?
Thuốc ung thư do Nga sản xuất vừa được cấp phép lưu hành tại Việt Nam, song để đưa vào phác đồ điều trị cần thêm hướng dẫn và đánh giá.
Báo VTC ngày 12/11/2025 đăng tin: "Thuốc ung thư của Nga được cấp phép ở Việt Nam: Bao giờ đưa vào điều trị?", nội dung cụ thể như sau:
Trao đổi với PV Báo Điện tử VTC News, PGS.TS Phạm Văn Bình, Phó Giám đốc Bệnh viện K – cơ sở chuyên khoa đầu ngành ung thư của cả nước cho biết, đơn vị chưa đưa thuốc Pembroria (sản phẩm chứa hoạt chất Pembrolizumab, do Nga sản xuất) vào phác đồ điều trị cho bệnh nhân.
Việc cập nhật thuốc mới trong điều trị ung thư luôn được đơn vị đặc biệt quan tâm, song cần tuân thủ quy trình chuyên môn và hướng dẫn chính thức của Bộ Y tế, cũng như Cục Quản lý Dược.
“ Chúng tôi luôn ưu tiên những tiến bộ trong điều trị ung thư nhằm mang lại cơ hội sống tốt hơn cho người bệnh. Dù vậy việc đưa loại thuốc mới vào sử dụng phải dựa trên căn cứ khoa học, khuyến cáo điều trị và sự cho phép của cơ quan quản lý ”, ông Bình nói.
Thông tin thêm về thuốc Pembroria, đại diện Cục Quản lý Dược (Bộ Y tế) cho biết, toàn bộ hồ sơ cấp phép lưu hành thuốc được doanh nghiệp nộp đầy đủ theo quy định. Thời điểm năm 2024, thuốc này đã hoàn tất các nghiên cứu lâm sàng. Tuy nhiên, doanh nghiệp tiếp tục thực hiện đánh giá về tính sinh miễn dịch - yêu cầu bắt buộc với nhóm thuốc sinh phẩm tương tự (biosimilar) như sản phẩm này, chứ không phải là thử nghiệm lâm sàng mới.
Tính sinh miễn dịch (immunogenicity) là khả năng mà thuốc sinh học có thể gây ra phản ứng miễn dịch trong cơ thể người dùng. Khi một thuốc biosimilar như Pembroria được sản xuất ở một quốc gia và muốn đăng ký lưu hành ở Việt Nam, Cục Quản lý Dược yêu cầu nộp hồ sơ đánh giá tính tương tự so với thuốc gốc và báo cáo đánh giá tính sinh miễn dịch trong dân số người bệnh tương ứng.
Hội đồng tư vấn cấp phép đã xem xét kỹ hồ sơ, đánh giá các dữ liệu về tính tương đồng sinh học so với thuốc gốc của hãng dược MSD - một công ty dược phẩm đa quốc gia của Mỹ đã được cấp phép lưu hành từ năm 2017 điều trị ung thư, cũng như báo cáo tính sinh miễn dịch. Đây là bước cần thiết trong quy trình cấp phép cho các thuốc sinh học tương tự, vốn có nhiều sản phẩm cùng dòng kháng thể đơn dòng trên thị trường.
Việc cấp giấy đăng ký lưu hành cho phép thuốc được nhập khẩu, phân phối và sử dụng tại Việt Nam như các thuốc khác, vì đây không phải thuộc nhóm thuốc đặc biệt hay bị hạn chế. Doanh nghiệp được phép kinh doanh theo đúng quy định thương mại hiện hành.
Trong quá trình lưu hành, doanh nghiệp có trách nhiệm theo dõi và báo cáo định kỳ về tính an toàn, hiệu quả và sinh miễn dịch của thuốc sau 3 năm hoặc 5 năm, theo yêu cầu của cơ quan quản lý.
Thuốc Pembroria phổ chỉ định rộng
Theo Thạc sĩ, bác sĩ Nguyễn Duy Anh, Trung tâm Ung bướu, Xạ trị và Y học hạt nhân Quốc tế (Bệnh viện Đa khoa Phương Đông), Pembroria là thuốc điều trị ung thư theo cơ chế miễn dịch, giúp kích hoạt hệ thống miễn dịch của cơ thể nhận diện và tiêu diệt tế bào ung thư. Trước đây, thuốc này chủ yếu được sản xuất bởi các hãng dược của Mỹ, nhưng hiện có thêm nhà sản xuất tại Nga, mở rộng nguồn cung ứng cho các quốc gia.
Sự đa dạng nguồn cung của thuốc miễn dịch này giống như trường hợp các loại kháng sinh thông dụng như Amoxicillin - có thể được sản xuất tại nhiều quốc gia như Pháp, Mỹ, Đức... vẫn cùng hoạt chất và tác dụng điều trị. Việc có thêm nhà máy sản xuất giúp mở rộng cơ hội tiếp cận thuốc, không làm thay đổi bản chất hay cơ chế tác dụng của sản phẩm.
Pembroria được sử dụng trong nhiều phác đồ điều trị các bệnh ung thư khác nhau, gồm ung thư phổi không tế bào nhỏ, u hắc tố, ung thư đại trực tràng, ung thư cổ tử cung, ung thư biểu mô tế bào thận và ung thư v:ú. Hiệu quả của thuốc được đánh giá cao, đặc biệt ở nhóm bệnh nhân được chỉ định đúng thể bệnh và có đáp ứng miễn dịch phù hợp.

Theo bác sĩ Duy Anh, việc mở rộng nguồn gốc sản xuất thuốc Pembroria giúp người bệnh có thêm lựa chọn, giảm áp lực chi phí và tăng khả năng tiếp cận các phương pháp điều trị tiên tiến. Tuy nhiên, việc sử dụng vẫn cần tuân thủ hướng dẫn của Bộ Y tế và chỉ định của bác sĩ điều trị, bởi thuốc miễn dịch có cơ chế phức tạp và yêu cầu theo dõi sát sao trong quá trình sử dụng.
Một bác sĩ điều trị ung bướu tại bệnh viện trên địa bàn Hà Nội cho biết, thuốc này chưa được bảo hiểm y tế chi trả. Hiện giá thành của thuốc Pembroria sản xuất có giá khoảng 20 triệu đồng/lọ. Bệnh nhân thường dùng 2 lọ cho 1 đợt điều trị. Bệnh nhân sẽ dùng kéo dài 12-24 đợt đến khi không còn đáp ứng với thuốc thì dừng. Mỗi tháng bệnh nhân sẽ điều trị 1 lần.
Cục Quản lý Dược (Bộ Y tế) vừa ban hành quyết định về việc cấp giấy đăng ký lưu hành cho 14 loại vắc-xin và sinh phẩm tại Việt Nam, thuộc đợt 57. Đáng chú ý, trong đó có thuốc Pembroria (hoạt chất chính là Pembrolizumab, hàm lượng 100mg/4ml) do Công ty Limited Liability "PK-137" (Nga) sản xuất. Đây là thuốc điều trị ung thư.
Thuốc do Công ty Anabion Pharmaceutical Trading Ltd (địa chỉ: Kizad Logistic Park Free Zone, Unit No. FZ-11, Taweelah, Abu Dhabi, Các Tiểu Vương quốc Ả Rập Thống nhất) đứng tên đăng ký. Cơ sở sản xuất là Limited Liability Company "PK-137", có trụ sở tại Moscow, Zelenograd, Liên bang Nga.
Liệu pháp miễn dịch được kỳ vọng sẽ mang lại hy vọng sống cho nhiều bệnh nhân ung thư, đặc biệt là những trường hợp ung thư đã kháng với các phương pháp điều trị truyền thống như hóa trị hay xạ trị.
Trong ngày, báo VnExpress cũng đăng bài: "Thuốc ung thư của Nga được cấp phép sử dụng, không phải thử nghiệm lâm sàng", cho biết Cục Quản lý Dược, Bộ Y tế, giải thích thuốc điều trị ung thư Pembroria do Nga sản xuất được cấp phép lưu hành rộng rãi tại Việt Nam chứ không phải cấp phép để thử nghiệm lâm sàng.
Ngày 12/11, đại diện Cục Quản lý Dược cho hay thuốc Pembroria đã hoàn tất các nghiên cứu lâm sàng vào năm 2024 và chính thức được cấp phép tại Việt Nam. Thuốc do công ty Biocad (Nga) sản xuất, được một doanh nghiệp có trụ sở tại UAE đăng ký.
"Việc cấp giấy đăng ký lưu hành cho phép thuốc được nhập khẩu, phân phối và sử dụng rộng rãi như các thuốc khác, vì không thuộc nhóm thuốc đặc biệt hay bị hạn chế", đại diện Cục Quản lý Dược cho biết.
Về bản chất, Pembroria là một "thuốc tương tự sinh học" (biosimilar), hay có thể hiểu là "bản sao" của thuốc Keytruda do tập đoàn MSD (Mỹ) phát triển. Cả hai cùng chứa hoạt chất Pembrolizumab, một kháng thể đơn dòng giúp hệ miễn dịch của cơ thể tự nhận diện và tấn công tế bào ung thư. Keytruda là một trong những liệu pháp miễn dịch điều trị ung thư phổ biến trên thế giới, được Mỹ phê duyệt lần đầu năm 2014. Còn Việt Nam cấp phép lưu hành thuốc Keytruda vào năm 2017.
Sự xuất hiện của Pembroria được kỳ vọng tăng cơ hội tiếp cận liệu pháp miễn dịch cho bệnh nhân, vốn có chi phí rất cao. Tại Việt Nam, giá Pembroria giai đoạn đầu khoảng 18 triệu đồng mỗi lọ trong khi thuốc Keytruda khoảng 55-65 triệu đồng một lọ. Hiện tại, cả hai thuốc này đều chưa được bảo hiểm y tế chi trả.
Cơ chế hoạt động của hoạt chất Pembrolizumab là nhắm vào các "chốt kiểm soát" miễn dịch. Thông thường, tế bào ung thư sử dụng một loại protein trên bề mặt để "bắt tay" với tế bào miễn dịch T, gửi đi tín hiệu "dừng" khiến tế bào T bị vô hiệu hóa. Thuốc sẽ ngăn chặn tương tác này, ví như "nhả phanh" cho hệ miễn dịch, giúp các tế bào T tái kích hoạt khả năng tiêu diệt khối u. Cơ chế này hiệu quả trên nhiều loại ung thư như u hắc tố, phổi, thận, cổ tử cung, theo trang web Pembroria giới thiệu.
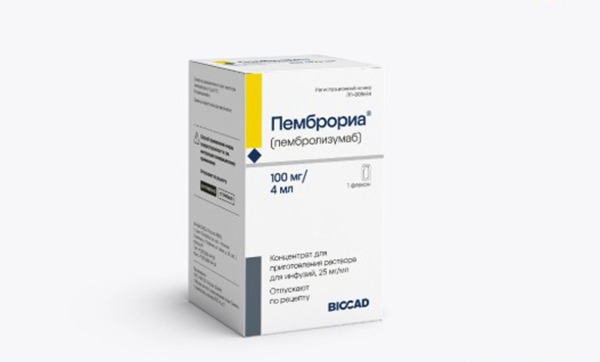
Tuy vậy, theo đại diện Cục Quản lý Dược, dù thuốc đáp ứng các tiêu chuẩn về an toàn và chất lượng để lưu hành, doanh nghiệp vẫn tiếp tục theo dõi, đánh giá tính sinh miễn dịch của thuốc trên người Việt Nam. Yêu cầu này được nêu cụ thể tại Điều 2, mục 5 trong Quyết định 628 của Cục Quản lý Dược cấp phép lưu hành. Theo đó, "cơ sở đăng ký phải định kỳ 3 tháng một lần cập nhật tiến độ triển khai nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III và nộp hồ sơ dữ liệu cập nhật khi thời gian nghiên cứu kết thúc".
"Điều này có nghĩa là trong quá trình lưu hành, doanh nghiệp tiếp tục thực hiện đánh giá về tính sinh miễn dịch - một yêu cầu bắt buộc với nhóm thuốc sinh phẩm tương tự (biosimilar)", đại diện Cục Quản lý Dược giải thích. Tính sinh miễn dịch (immunogenicity) là khả năng mà một thuốc sinh học có thể gây ra phản ứng miễn dịch trong cơ thể người dùng.
Một chuyên gia dược (không muốn nêu tên) nhận định cơ chế này cho phép bệnh nhân ung thư Việt Nam tiếp cận sớm hơn với liệu pháp miễn dịch tiên tiến, một giải pháp quan trọng trong bối cảnh nhu cầu điều trị ung thư tăng cao. Đổi lại, cơ sở đăng ký và sản xuất phải chịu trách nhiệm pháp lý cao, cam kết cung cấp dữ liệu lâm sàng chi tiết và định kỳ 3 tháng một lần để theo dõi hiệu quả và an toàn trên quần thể bệnh nhân trong nước.
Việc giám sát chặt chẽ này đảm bảo mọi vấn đề về tính sinh miễn dịch hoặc tác dụng không mong muốn đều được cơ quan quản lý phát hiện và xử lý kịp thời, giảm thiểu rủi ro cho bệnh nhân. Nếu dữ liệu không đạt yêu cầu, giấy đăng ký lưu hành có thể không được gia hạn, củng cố tính khoa học và trách nhiệm giải trình trong hệ thống y tế quốc gia, theo chuyên gia trên.
Tại Nga, Pembroria được phê duyệt từ tháng 4/2022 trong một bối cảnh đặc biệt. Khi ấy, do lo ngại thiếu hụt thuốc gốc Keytruda sau các lệnh trừng phạt kinh tế, chính phủ Nga ban hành nghị định cho phép áp dụng "cơ chế đăng ký cấp tốc". Lợi thế chính của Pembroria là giá cả, khi thuốc có giá thấp hơn 25% so với Keytruda, giúp nhanh chóng thống lĩnh thị trường mua sắm công, tăng thị phần từ 11% lên 83% chỉ sau một quý.