Tin vui: Việt Nam cấp phép lưu hành thuốc chữa ung thư của Nga
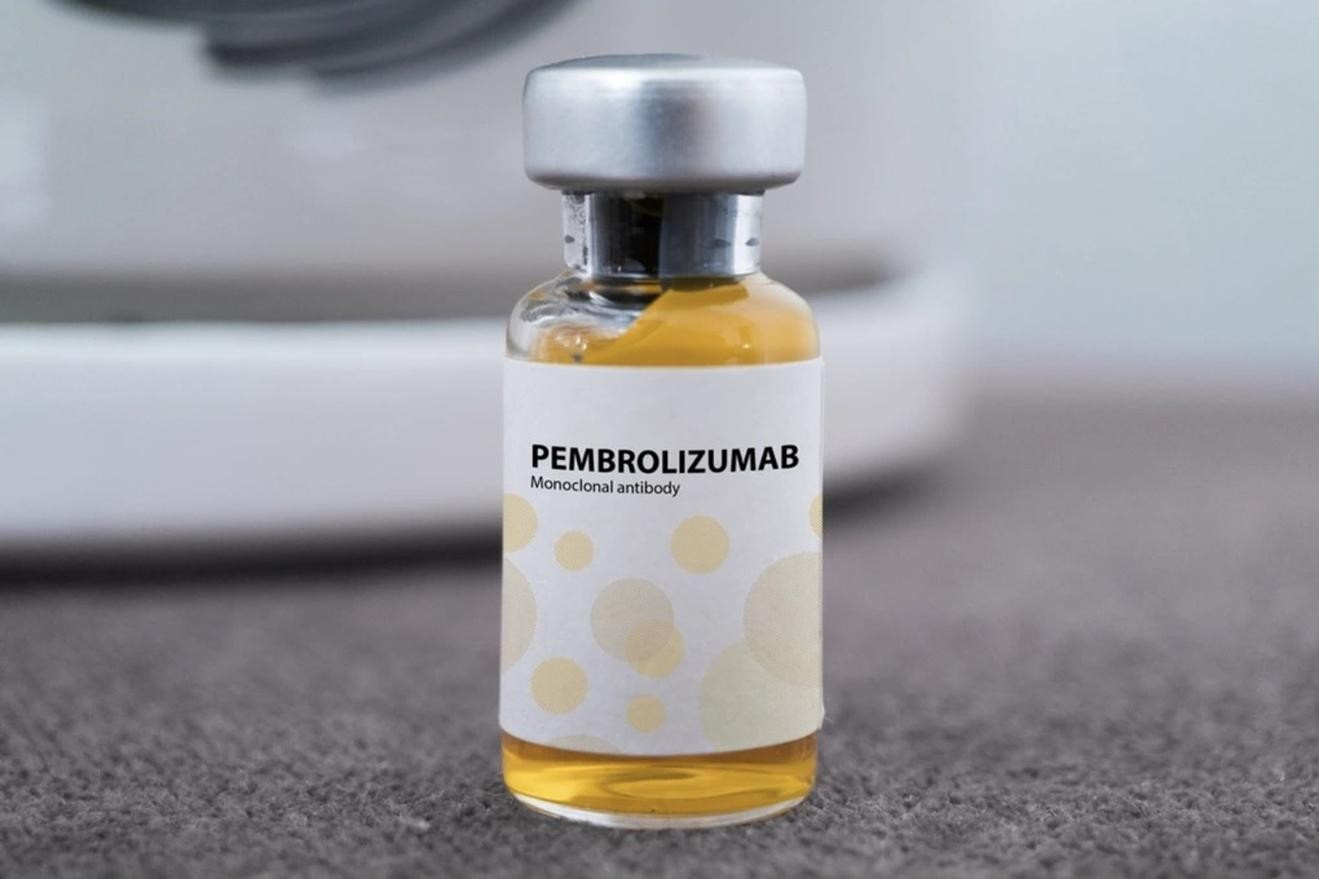
Thuốc Pembroria chứa hoạt chất chính Pembrolizumab hàm lượng 100mg/4ml, do Công ty Limited Liability "PK-137" (Nga) sản xuất và một cơ sở tại Các Tiểu vương quốc Ả Rập Thống nhất đăng ký. Thuốc được bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, hạn sử dụng 24 tháng kể từ ngày sản xuất.
Theo Chuyên trang Góc nhìn pháp lý có bài Tin vui: Việt Nam cấp phép lưu hành thuốc chữa UT của Nga. Nội dung như sau:
Báo VnExpress cho biết, ngày 11/11, đại diện Cục Quản lý Dược, Bộ Y tế, cho biết thuốc Pembroria do Nga sản xuất là một trong 14 vaccine, sinh phẩm được Cục phê duyệt vào cuối tháng 10.

Thuốc Pembroria chứa hoạt chất chính Pembrolizumab hàm lượng 100mg/4ml, do Công ty Limited Liability "PK-137" (Nga) sản xuất và một cơ sở tại Các Tiểu vương quốc Ả Rập Thống nhất đăng ký. Thuốc được bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, hạn sử dụng 24 tháng kể từ ngày sản xuất.
Thuốc có phổ chỉ định rộng, dùng trong điều trị nhiều loại UT như UT biểu mô phổi, u hắc tố, UT đại trực tràng, UT cổ tử cung, UT biểu mô tế bào thận, UT vú... Sản phẩm được cấp phép lưu hành tại Việt Nam giúp người bệnh thêm cơ hội tiếp cận các liệu pháp tiên tiến.
Theo đại diện Cục quản lý Dược, thuốc Pembroria là một loại kháng thể đơn dòng sản xuất theo thuốc gốc (sinh phẩm tham chiếu gốc) của hãng dược MSD - một công ty dược phẩm đa quốc gia của Mỹ đã được cấp phép lưu hành từ năm 2017 điều trị UT.
Báo Người Lao Động thông tin thêm, đại diện Cục Quản lý Dược cho biết ngoài loại thuốc của Nga vừa được cấp phép, hiện Việt Nam có 99 loại thuốc điều trị UT đang lưu hành.
"Đây là một loại kháng thể đơn dòng, không phải thuốc mới. Sản phẩm tương tự này dựa trên sinh phẩm tham chiếu gốc của hãng MSD (Mỹ), đã được cấp phép lưu hành tại nước ta từ năm 2017 và hiện đang được sử dụng điều trị cho bệnh nhân UT. Loại sinh phẩm mới, có tên Pembroria, vừa được cấp phép có cơ chế giống sản phẩm gốc nhưng được sản xuất tại Nga"- vị đại diện Cục Quản lý dược thông tin.
Theo một bác sĩ điều trị ung bướu, thuốc này chưa được BHYT chi trả. Hiện giá thành của thuốc Pembroria sản xuất có giá khoảng 20 triệu đồng/lọ. Bệnh nhân thường dùng 2 lọ cho 1 đợt điều trị. Bệnh nhân sẽ được dùng kéo dài 12-24 đợt đến khi không còn đáp ứng với thuốc thì dừng. Mỗi tháng bệnh nhân sẽ điều trị 1 lần.
Liệu pháp miễn dịch được kỳ vọng sẽ mang lại hy vọng sống cho nhiều bệnh nhân UT, đặc biệt là những trường hợp UT đã kháng với các phương pháp điều trị truyền thống như hóa trị hay xạ trị.
Ưu điểm của thuốc miễn dịch chữa UT là tập trung vào việc sử dụng chính hệ miễn dịch của cơ thể để tiêu diệt tế bào UT, thay vì tác động trực tiếp vào tế bào UT như hóa trị, xạ trị. Nhiều nghiên cứu đang tập trung vào việc nâng cao hiệu quả và mở rộng phạm vi ứng dụng của liệu pháp này.
Theo quyết định, việc cấp phép được thực hiện trên cơ sở kết luận của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc và nguyên liệu làm thuốc - Bộ Y tế. Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng ký thuốc phải tuân thủ đầy đủ các quy định của pháp luật Việt Nam và hướng dẫn của Bộ Y tế về sản xuất, nhập khẩu và lưu hành thuốc.
Các đơn vị này có trách nhiệm cung cấp thuốc theo đúng hồ sơ đã đăng ký, ghi rõ số đăng ký do Bộ Y tế cấp trên nhãn sản phẩm, đồng thời báo cáo kịp thời nếu có bất kỳ thay đổi nào trong quá trình lưu hành tại nước sở tại hoặc tại Việt Nam.
Cục Quản lý Dược cũng yêu cầu sau khi được cấp giấy đăng ký lưu hành thuốc, công ty phải định kỳ 3 tháng một lần kể từ ngày cấp giấy đăng ký lưu hành thực hiện cập nhật tiến độ triển khai nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III và nộp hồ sơ thay đổi, bổ sung, cập nhật dữ liệu theo dõi tính sinh miễn dịch khi thời gian nghiên cứu kết thúc.
Theo báo Tiền Phong có bài Thông tin mới nhất về thuốc chống UT của Nga chính thức được sử dụng tại Việt Nam. Nội dung như sau:
Cục Quản lý Dược (Bộ Y tế) đã chính thức ban hành Quyết định về việc cấp giấy đăng kí lưu hành cho 14 loại vắc xin và sinh phẩm tại Việt Nam, thuộc đợt 57. Đáng chú ý trong đó có thuốc thuốc Pembroria (hoạt chất chính là Pembrolizumab, hàm lượng 100mg/4ml) do Công ty Limited Liability "PK-137" (Nga) sản xuất điều trị UT.
Chiều 11/11, trao đổi với phóng viên báo Tiền Phong, GS.TS Lê Văn Quảng, Giám đốc Bệnh viện K cho biết, Bệnh viện K sẽ sớm đưa thuốc này vào điều trị cho bệnh nhân. Theo GS. Quảng, thuốc này chưa được bảo hiểm y tế chi trả. Hiện giá thành của thuốc Pembroria do Công ty Limited Liability "PK-137" (Nga) sản xuất có giá khoảng 18 triệu đồng/lọ. Bệnh nhân thường dùng 2 lọ cho 1 đợt điều trị. “Bệnh nhân sẽ được dùng kéo dài 12-24 đợt đến khi không còn đáp ứng với thuốc thì dừng. Mỗi tháng bệnh nhân sẽ điều trị 1 lần”, GS.TS Lê Văn Quảng thông tin.
Các chuyên gia y tế đánh giá liệu pháp miễn dịch là một bước tiến quan trọng trong điều trị UT, có khả năng kích hoạt hệ miễn dịch của cơ thể để chống lại tế bào UT. Liệu pháp miễn dịch được kì vọng sẽ mang lại hi vọng sống cho nhiều bệnh nhân UT, đặc biệt là những trường hợp UT đã kháng với các phương pháp điều trị truyền thống như hóa trị hay xạ trị.
Ưu điểm của thuốc miễn dịch chữa UT là tập trung vào việc sử dụng chính hệ miễn dịch của cơ thể để tiêu diệt tế bào UT, thay vì tác động trực tiếp vào tế bào UT như hóa trị, xạ trị. Nhiều nghiên cứu đang tập trung vào việc nâng cao hiệu quả và mở rộng phạm vi ứng dụng của liệu pháp này.
Theo danh mục đợt 57 các vắc xin và sinh phẩm được cấp giấy đăng kí lưu hành do Cục Quản lý Dược (Bộ Y tế) ban hành, thuốc Pembroria (Pembrolizumab) 100mg/4ml chống UT do Nga sản xuất đã chính thức được phép lưu hành tại Việt Nam.
Thuốc Pembroria (Pembrolizumab) 100mg/4ml do Công ty Anabion Pharmaceutical Trading Ltd (địa chỉ: Kizad Logistic Park Free Zone, Unit No. FZ-11, Taweelah, Abu Dhabi, Các Tiểu Vương quốc Ả Rập Thống nhất) đứng tên đăng kí. Cơ sở sản xuất là Limited Liability Company “PK-137”, có trụ sở tại Moscow, Zelenograd, Liên bang Nga.
Pembroria là thuốc dung dịch đậm đặc để pha dung dịch tiêm truyền, được đóng gói dưới dạng hộp 1 lọ x 4ml, đạt tiêu chuẩn cơ sở (TCCS 24 460410440025).
Pembrolizumab có hơn 14 chỉ định cho các loại bệnh UT khác nhau (như UT biểu mô phổi, u hắc tố, UT đại trực tràng, UT cổ tử cung, UT biểu mô tế bào thận, UT vú...).
Việc cấp phép lưu hành thuốc Pembroria mở rộng thêm lựa chọn điều trị cho bệnh nhân, đặc biệt trong nhóm thuốc điều trị UT có hoạt chất Pembrolizumab, một kháng thể đơn dòng được sử dụng phổ biến trong liệu pháp miễn dịch. Các cơ sở đăng kí và sản xuất có trách nhiệm tuân thủ nghiêm ngặt quy định của Bộ Y tế về chất lượng, an toàn và hiệu quả khi lưu hành sản phẩm tại Việt Nam.
Theo Quyết định, việc cấp phép được thực hiện trên cơ sở kết luận của Hội đồng tư vấn cấp giấy đăng kí lưu hành thuốc và nguyên liệu làm thuốc - Bộ Y tế. Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng kí thuốc phải tuân thủ đầy đủ các quy định của pháp luật Việt Nam và hướng dẫn của Bộ Y tế về sản xuất, nhập khẩu và lưu hành thuốc. Các đơn vị này có trách nhiệm cung cấp thuốc theo đúng hồ sơ đã đăng kí, ghi rõ số đăng kí do Bộ Y tế cấp trên nhãn sản phẩm, đồng thời báo cáo kịp thời nếu có bất kỳ thay đổi nào trong quá trình lưu hành tại nước sở tại hoặc tại Việt Nam.
Cục cũng nhấn mạnh, các cơ sở đăng kí thuốc phải đảm bảo duy trì tiêu chuẩn “Thực hành tốt sản xuất” (GMP). Trường hợp bị thu hồi giấy phép hoặc không còn đáp ứng yêu cầu GMP tại nước sở tại, cơ sở phải báo cáo cho Cục Quản lý Dược trong vòng 15 ngày kể từ khi có thông báo của cơ quan quản lý nước ngoài.
Ngoài ra, các đơn vị đăng kí thuốc cần phối hợp với các cơ sở y tế điều trị và dự phòng để theo dõi an toàn, hiệu quả, và tác dụng không mong muốn của các loại vắc xin, sinh phẩm trong quá trình sử dụng tại Việt Nam, đồng thời tổng hợp và báo cáo định kỳ theo quy định của Bộ Y tế.
Đáng chú ý, đối với thuốc có số thứ tự 1 trong danh mục kèm theo Quyết định, doanh nghiệp phải định kỳ 3 tháng một lần cập nhật tiến độ nghiên cứu lâm sàng pha III về tính sinh miễn dịch và nộp hồ sơ bổ sung khi nghiên cứu kết thúc.
Quyết định có hiệu lực kể từ ngày kí ban hành. Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương cùng các cơ sở sản xuất, đăng kí thuốc có tên trong danh mục chịu trách nhiệm thi hành.